Capítulo 3: Eletrólise
Olá! Sou o Leo novamente. Neste capítulo, vamos explorar a eletrólise, que é o processo inverso das pilhas que estudamos anteriormente. Enquanto as pilhas transformam energia química em energia elétrica espontaneamente, a eletrólise usa energia elétrica para forçar reações químicas não-espontâneas. É um processo fascinante com muitas aplicações industriais importantes!
O que é Eletrólise?
A eletrólise é um processo eletroquímico no qual a energia elétrica é utilizada para provocar reações químicas não-espontâneas. Em outras palavras, é o processo inverso do que ocorre nas pilhas e baterias. Enquanto nas pilhas a reação química espontânea gera corrente elétrica, na eletrólise a corrente elétrica força uma reação química que não ocorreria naturalmente.
O termo "eletrólise" vem do grego: "electro" (eletricidade) e "lysis" (quebra ou separação). De fato, a eletrólise frequentemente causa a decomposição de substâncias, como na separação da água em hidrogênio e oxigênio.
Comparação entre Células Galvânicas e Células Eletrolíticas
Olá! Sou a Sofia. Para entender bem a eletrólise, é útil compará-la com as células galvânicas (pilhas) que estudamos no capítulo anterior. Embora ambas envolvam reações redox, elas funcionam de maneiras opostas. Vamos ver as principais diferenças:
| Característica | Célula Galvânica (Pilha) | Célula Eletrolítica |
|---|---|---|
| Direção da reação | Espontânea (ΔG < 0) | Não-espontânea (ΔG > 0) |
| Energia | Produz energia elétrica | Consome energia elétrica |
| Ânodo | Polo negativo (oxidação) | Polo positivo (oxidação) |
| Cátodo | Polo positivo (redução) | Polo negativo (redução) |
| Fluxo de elétrons | Do ânodo para o cátodo pelo circuito externo | Da fonte de energia para o cátodo e do ânodo para a fonte |
| Força motriz | Diferença de potencial gerada pela reação química | Fonte externa de energia elétrica |
| Aplicações típicas | Baterias, pilhas, células de combustível | Obtenção de metais, galvanoplastia, produção de gases |
Uma diferença importante a ser destacada é a polaridade dos eletrodos. Na eletrólise, o ânodo (onde ocorre a oxidação) é o polo positivo, enquanto o cátodo (onde ocorre a redução) é o polo negativo. Isso é o oposto do que acontece nas pilhas!
Componentes de uma Célula Eletrolítica
Uma célula eletrolítica típica é composta pelos seguintes componentes:
- Fonte de energia elétrica: Geralmente uma bateria ou fonte de alimentação DC que fornece a energia necessária para a reação não-espontânea.
- Eletrodos: Condutores metálicos ou de carbono que transferem elétrons entre a fonte de energia e o eletrólito.
- Ânodo (+): Conectado ao polo positivo da fonte, é onde ocorre a oxidação.
- Cátodo (-): Conectado ao polo negativo da fonte, é onde ocorre a redução.
- Eletrólito: Substância que contém íons livres e conduz eletricidade. Pode ser uma solução aquosa, um sal fundido ou um sólido iônico.
- Cuba eletrolítica: Recipiente que contém o eletrólito e os eletrodos.
Tipos de Eletrólise
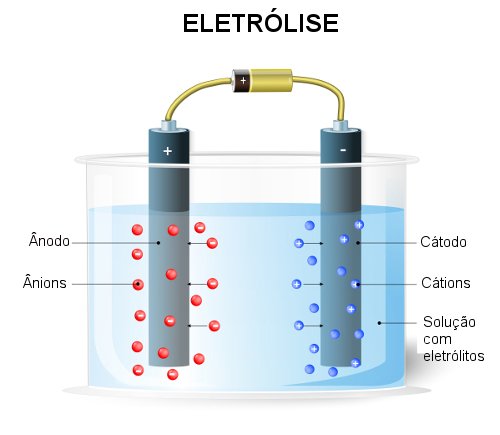
Existem dois tipos principais de eletrólise, dependendo do estado físico do eletrólito:
1. Eletrólise Ígnea (de Sais Fundidos)
Neste tipo de eletrólise, o eletrólito é um composto iônico fundido (derretido). Como não há água presente, as reações são mais simples e envolvem apenas os íons do composto fundido.
Exemplo: Eletrólise do cloreto de sódio (NaCl) fundido
- No ânodo (+): 2Cl- → Cl2 + 2e- (oxidação)
- No cátodo (-): Na+ + e- → Na (redução)
- Reação global: 2NaCl → 2Na + Cl2
2. Eletrólise Aquosa (em Solução)
Neste tipo, o eletrólito é um composto iônico dissolvido em água. A situação é mais complexa porque a água também pode participar das reações redox, competindo com os íons do eletrólito.
Na eletrólise aquosa, precisamos considerar:
- Os potenciais de redução padrão para determinar quais espécies serão preferencialmente oxidadas ou reduzidas
- A concentração das espécies em solução
- A natureza dos eletrodos (inertes ou ativos)
- O sobrepotencial necessário para algumas reações
Eletrólise da Água: Um Exemplo Clássico
Olá! Sou o Davi. A eletrólise da água é um dos exemplos mais conhecidos e didáticos de eletrólise. Vamos ver como funciona esse processo que decompõe a água em seus elementos constituintes: hidrogênio e oxigênio.
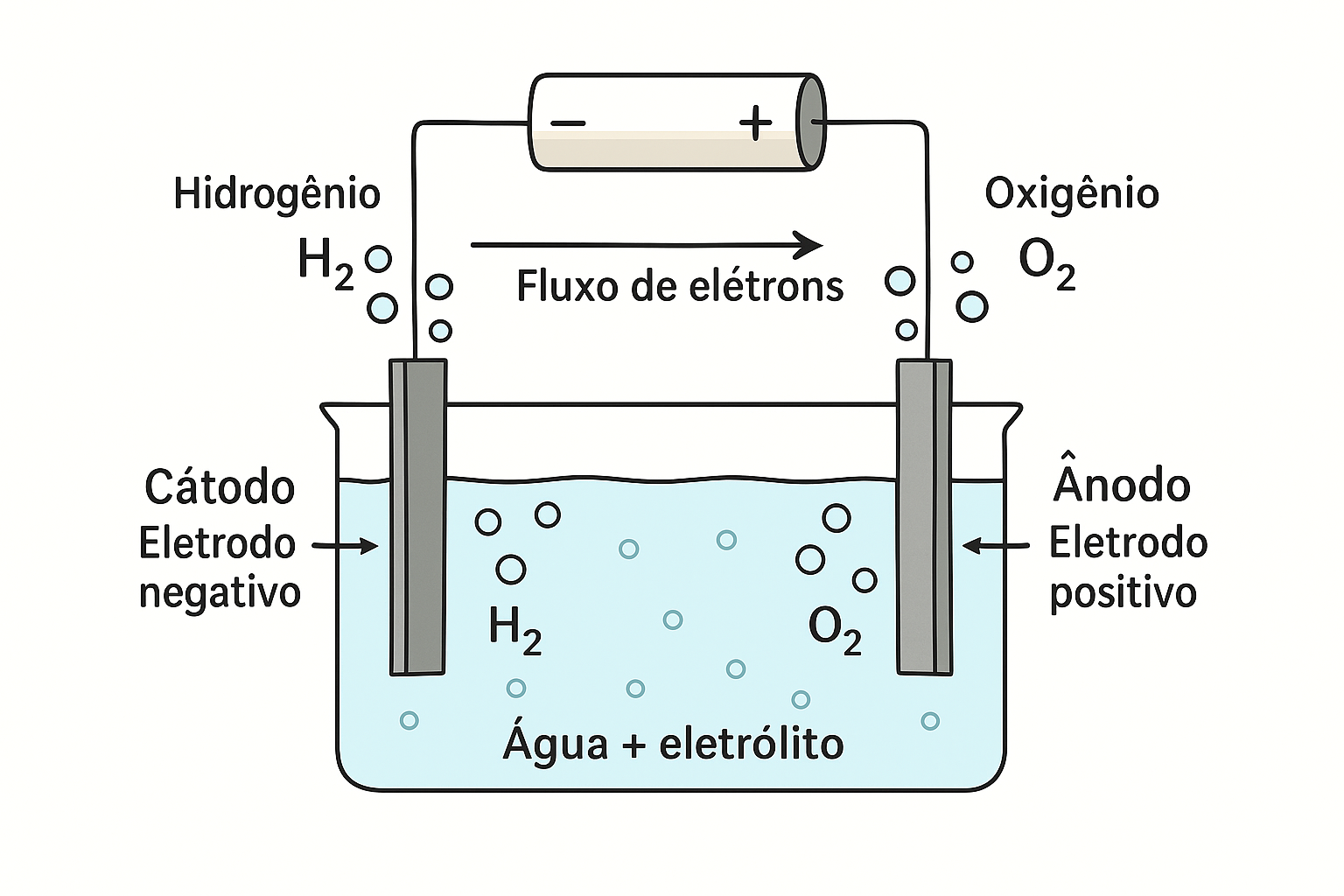
Diagrama da eletrólise da água
Na eletrólise da água, utilizamos água pura com um pouco de eletrólito (geralmente H2SO4 ou NaOH) para aumentar a condutividade, e eletrodos inertes (geralmente de platina ou grafite).
Reações da Eletrólise da Água:
- No cátodo (-): 2H2O + 2e- → H2 + 2OH- (redução)
- No ânodo (+): 2H2O → O2 + 4H+ + 4e- (oxidação)
- Reação global: 2H2O → 2H2 + O2
Observe que a proporção entre hidrogênio e oxigênio produzidos é de 2:1 em volume, o que está de acordo com a fórmula da água (H2O).
Para que esta reação ocorra, é necessário aplicar uma diferença de potencial mínima de 1,23 V. Na prática, devido a fatores como resistência da solução e sobrepotencial nos eletrodos, utiliza-se geralmente uma tensão entre 2 e 3 V.
Leis de Faraday para a Eletrólise
Michael Faraday, cientista britânico do século XIX, estabeleceu duas leis fundamentais que relacionam a quantidade de substância produzida em uma eletrólise com a quantidade de eletricidade que passa pela célula eletrolítica:
Primeira Lei de Faraday
"A massa de uma substância produzida em um eletrodo durante a eletrólise é diretamente proporcional à quantidade de eletricidade (carga elétrica) que passa através da solução."
m = k × Q
Onde:
- m = massa da substância produzida (g)
- k = constante de proporcionalidade (g/C)
- Q = quantidade de carga elétrica (C)
Como Q = I × t (corrente × tempo), podemos reescrever:
m = k × I × t
Segunda Lei de Faraday
"Para uma mesma quantidade de eletricidade, as massas de diferentes substâncias produzidas nos eletrodos são proporcionais aos seus equivalentes químicos."
O equivalente químico de uma substância é sua massa molar dividida pelo número de elétrons envolvidos na reação redox:
E = M / n
Onde:
- E = equivalente químico (g/mol)
- M = massa molar (g/mol)
- n = número de elétrons transferidos
Combinando as duas leis, chegamos à equação geral da eletrólise:
m = (M × I × t) / (n × F)
Onde:
- m = massa da substância produzida (g)
- M = massa molar da substância (g/mol)
- I = corrente elétrica (A)
- t = tempo (s)
- n = número de elétrons transferidos
- F = constante de Faraday (96.485 C/mol)
Estas leis são fundamentais para cálculos em processos industriais de eletrólise, permitindo determinar a quantidade de produto formado ou a energia necessária para um processo específico.
Aplicações Industriais da Eletrólise
A eletrólise tem numerosas aplicações industriais importantes:
1. Obtenção de Metais
- Produção de alumínio: O processo Hall-Héroult utiliza eletrólise da alumina (Al2O3) dissolvida em criolita fundida para produzir alumínio metálico.
- Obtenção de sódio e magnésio: Eletrólise de cloreto de sódio (NaCl) e cloreto de magnésio (MgCl2) fundidos, respectivamente.
- Refino de cobre: Eletrólise para purificar cobre bruto, obtendo cobre com 99,99% de pureza.
2. Produção de Substâncias Químicas
- Cloro e soda cáustica: Eletrólise de solução aquosa de NaCl (salmoura) produz Cl2, H2 e NaOH, importantes insumos para a indústria química.
- Hidrogênio e oxigênio: Eletrólise da água para produção de gases de alta pureza.
- Percloratos e persulfatos: Oxidação eletrolítica de cloratos e sulfatos.
3. Galvanoplastia
Processo de revestimento de um objeto com uma fina camada de metal usando eletrólise. Aplicações incluem:
- Cromação: Revestimento com cromo para proteção contra corrosão e fins decorativos.
- Niquelação: Revestimento com níquel para proteção e acabamento.
- Douração e prateação: Revestimento com ouro ou prata para joalheria e eletrônicos.
- Zincagem: Revestimento com zinco para proteção contra corrosão (galvanização).
4. Eletrorrefinação e Eletroextração
- Purificação de metais: Remoção de impurezas de metais como cobre, prata, ouro e zinco.
- Recuperação de metais: Extração de metais de soluções diluídas, como na mineração.
5. Anodização
Processo eletrolítico que cria uma camada protetora de óxido na superfície de metais, especialmente alumínio, aumentando a resistência à corrosão e permitindo coloração.
6. Eletrossíntese Orgânica
Uso da eletrólise para realizar reações de síntese orgânica, como oxidações, reduções e acoplamentos.
Exercícios Interativos
Vamos testar seus conhecimentos sobre eletrólise:
1. Na eletrólise, o ânodo é conectado ao polo:
2. Na eletrólise da água, qual é a proporção em volume entre o hidrogênio e o oxigênio produzidos?
3. Segundo as Leis de Faraday, a massa de substância produzida em uma eletrólise é diretamente proporcional a:
Mapa Mental do Capítulo
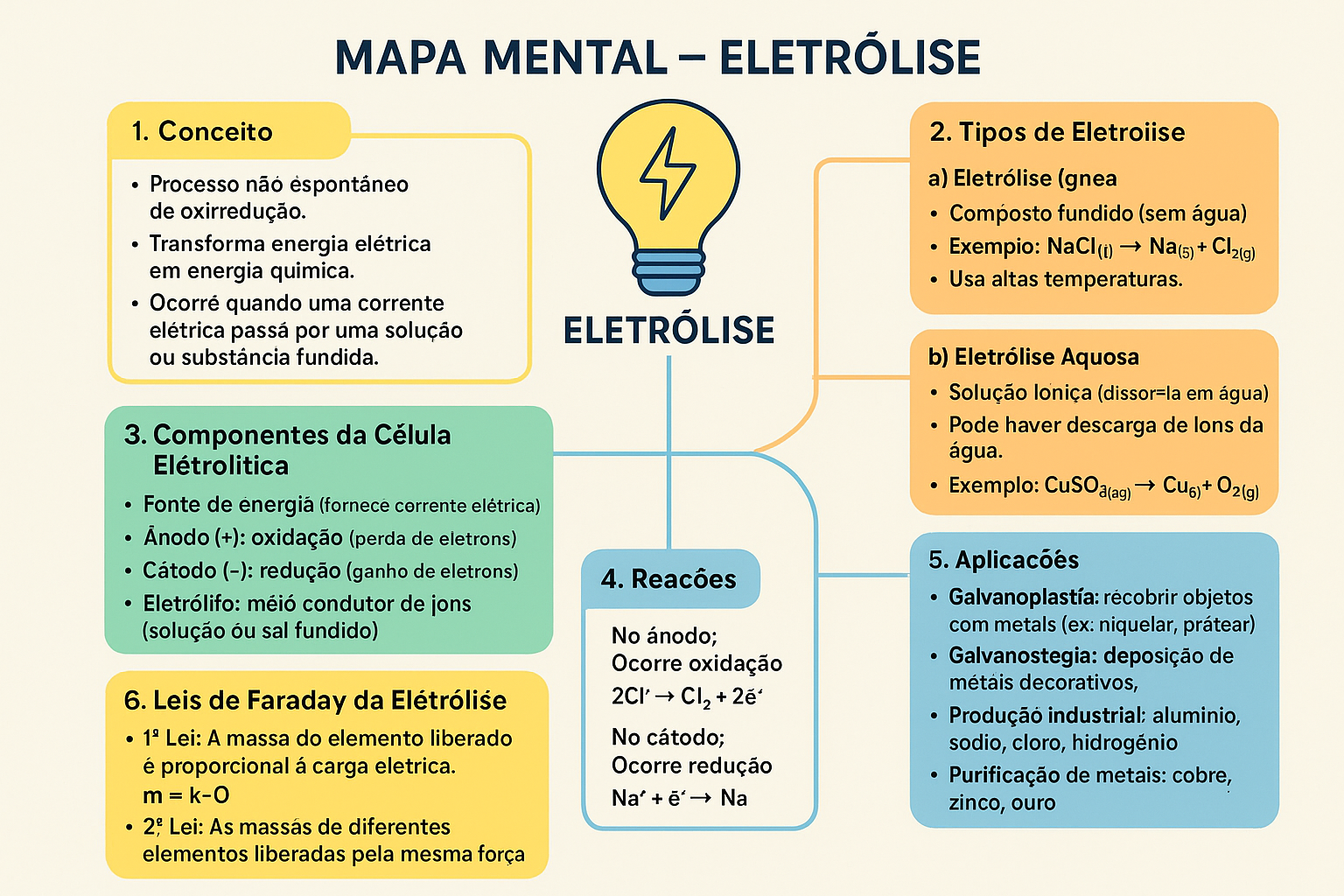
Descrição do mapa mental: Este mapa mental, com o título central 'Eletrólise', é dividido em seis seções principais: 1. Conceito (processo não espontâneo que transforma energia elétrica em química); 2. Tipos de Eletrólise (ígnea e aquosa); 3. Componentes da Célula Eletrolítica (fonte de energia, ânodo, cátodo, eletrólito); 4. Reações (oxidação no ânodo e redução no cátodo); 5. Aplicações (galvanoplastia, galvanostegia, produção industrial, purificação de metais); e 6. Leis de Faraday da Eletrólise (1ª e 2ª Lei). O mapa utiliza cores e caixas para organizar visualmente os tópicos.
Libras: Conteúdo em Língua Brasileira de Sinais
Aqui você encontrará a tradução em Libras do conteúdo principal deste capítulo. Nosso objetivo é tornar o aprendizado de Eletroquímica acessível a todos!