Capítulo 2: Pilhas Eletroquímicas
Olá! Sou o Davi. Neste capítulo, vamos explorar as pilhas eletroquímicas, que são dispositivos que transformam energia química em energia elétrica através de reações de oxirredução espontâneas. Vamos entender como elas funcionam e por que são tão importantes no nosso dia a dia!
O que são Pilhas Eletroquímicas?
Pilhas eletroquímicas, também chamadas de células galvânicas ou voltaicas, são dispositivos que convertem energia química em energia elétrica através de reações de oxirredução espontâneas. Diferentemente da eletrólise (que veremos no próximo capítulo), as pilhas aproveitam a tendência natural de transferência de elétrons para gerar corrente elétrica.
O princípio básico de funcionamento das pilhas foi descoberto pelo cientista italiano Alessandro Volta em 1799, quando ele empilhou discos alternados de zinco e cobre separados por papel embebido em solução salina, criando a primeira "pilha voltaica". Desde então, esse princípio evoluiu para as diversas tecnologias de baterias que usamos hoje.
Componentes de uma Pilha
Olá novamente! Sou o Leo. Para entender bem como uma pilha funciona, precisamos conhecer seus componentes principais. Vamos ver cada um deles:
- Ânodo: É o eletrodo onde ocorre a oxidação (perda de elétrons). É o polo negativo da pilha e funciona como "fornecedor" de elétrons para o circuito externo.
- Cátodo: É o eletrodo onde ocorre a redução (ganho de elétrons). É o polo positivo da pilha e funciona como "receptor" de elétrons do circuito externo.
- Eletrólitos: São soluções condutoras que contêm íons e permitem o fluxo de carga dentro da pilha.
- Ponte salina ou membrana porosa: Dispositivo que conecta os dois compartimentos da pilha, permitindo o fluxo de íons para manter a neutralidade elétrica, mas impedindo a mistura direta das soluções.
- Circuito externo: Fio condutor que conecta os eletrodos, permitindo o fluxo de elétrons do ânodo para o cátodo.
A Pilha de Daniell: Um Exemplo Clássico
A Pilha de Daniell, desenvolvida pelo químico britânico John Frederic Daniell em 1836, é um exemplo clássico que ilustra perfeitamente o funcionamento de uma pilha eletroquímica. Vamos analisá-la em detalhes:
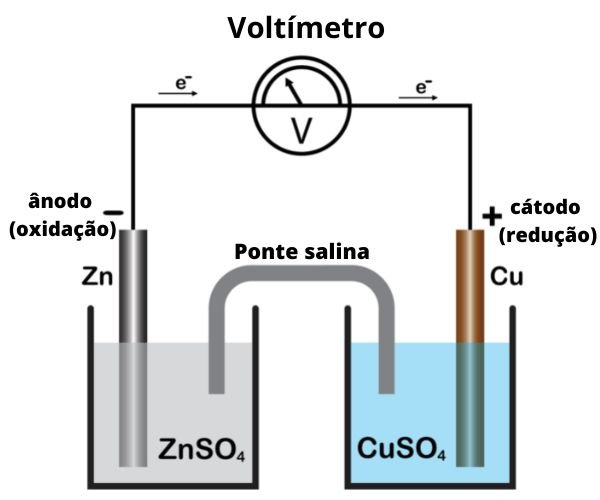
Diagrama de uma Pilha de Daniell
Componentes da Pilha de Daniell:
- Compartimento 1: Eletrodo de zinco (Zn) mergulhado em solução de sulfato de zinco (ZnSO4)
- Compartimento 2: Eletrodo de cobre (Cu) mergulhado em solução de sulfato de cobre (CuSO4)
- Ponte salina: Geralmente contendo solução de KCl ou KNO3
- Circuito externo: Fio condutor conectando os eletrodos, geralmente com um voltímetro ou dispositivo a ser alimentado
Funcionamento da Pilha de Daniell:
- No ânodo (eletrodo de zinco):
- Ocorre a oxidação: Zn(s) → Zn2+(aq) + 2e-
- O zinco metálico perde elétrons e se dissolve na solução como íons Zn2+
- Os elétrons liberados fluem pelo circuito externo
- No cátodo (eletrodo de cobre):
- Ocorre a redução: Cu2+(aq) + 2e- → Cu(s)
- Os íons Cu2+ da solução recebem elétrons e se depositam como cobre metálico no eletrodo
- Na ponte salina:
- Íons negativos (como Cl-) migram para o compartimento do ânodo para neutralizar o excesso de íons Zn2+
- Íons positivos (como K+) migram para o compartimento do cátodo para neutralizar o déficit de íons Cu2+
- Isso mantém a neutralidade elétrica em ambos os compartimentos
A reação global da Pilha de Daniell é: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Esta pilha gera uma diferença de potencial (ddp) de aproximadamente 1,10 V em condições padrão.
Potencial de Redução e Força Eletromotriz
Olá! Sou a Sofia. Agora vamos entender como calcular a voltagem de uma pilha. Para isso, usamos os potenciais de redução padrão, que são valores que indicam a tendência de uma espécie química em receber elétrons (ser reduzida). Mesmo sem enxergar, consigo compreender esses conceitos através de modelos táteis e analogias!
Potencial de Redução Padrão (E°)
O potencial de redução padrão (E°) é medido em relação ao eletrodo padrão de hidrogênio, que tem potencial definido como zero. Quanto mais positivo for o valor de E°, maior é a tendência da espécie em receber elétrons (ser reduzida).
Alguns valores importantes de E° (a 25°C):
- Li+ + e- → Li: E° = -3,05 V
- Zn2+ + 2e- → Zn: E° = -0,76 V
- 2H+ + 2e- → H2: E° = 0,00 V (referência)
- Cu2+ + 2e- → Cu: E° = +0,34 V
- Ag+ + e- → Ag: E° = +0,80 V
- F2 + 2e- → 2F-: E° = +2,87 V
Cálculo da Força Eletromotriz (ΔE°)
A força eletromotriz (ΔE°) de uma pilha é a diferença entre o potencial de redução do cátodo e o potencial de redução do ânodo:
ΔE° = E°cátodo - E°ânodo
Para a Pilha de Daniell:
- E°cátodo = E°Cu²⁺/Cu = +0,34 V
- E°ânodo = E°Zn²⁺/Zn = -0,76 V
- ΔE° = +0,34 V - (-0,76 V) = +1,10 V
O valor positivo de ΔE° indica que a reação é espontânea e pode gerar corrente elétrica.
Equação de Nernst
Em condições não-padrão (concentrações diferentes de 1 mol/L, temperaturas diferentes de 25°C), usamos a Equação de Nernst para calcular o potencial real da pilha:
E = E° - (RT/nF) ln Q
Onde:
- E = potencial real da pilha
- E° = potencial padrão da pilha
- R = constante dos gases (8,314 J/mol·K)
- T = temperatura em Kelvin
- n = número de elétrons transferidos
- F = constante de Faraday (96.485 C/mol)
- Q = quociente da reação
A 25°C, esta equação pode ser simplificada para:
E = E° - (0,0592/n) log Q
Tipos de Pilhas
Existem diversos tipos de pilhas e baterias utilizadas atualmente, cada uma com características específicas:
Pilhas Primárias (não recarregáveis)
- Pilha de Zinco-Carbono (Leclanché): Usada em dispositivos de baixo consumo. Ânodo de zinco, cátodo de grafite e eletrólito de cloreto de amônio e cloreto de zinco.
- Pilha Alcalina: Mais duráveis que as de zinco-carbono. Ânodo de zinco em pó, cátodo de dióxido de manganês e eletrólito de hidróxido de potássio.
- Pilha de Lítio: Alta densidade energética. Ânodo de lítio metálico e vários tipos de cátodos (dióxido de manganês, fluoreto de carbono, etc.).
Pilhas Secundárias (recarregáveis)
- Bateria de Chumbo-Ácido: Usada em automóveis. Ânodo de chumbo, cátodo de dióxido de chumbo e eletrólito de ácido sulfúrico.
- Bateria de Níquel-Cádmio (NiCd): Ânodo de cádmio, cátodo de hidróxido de níquel e eletrólito de hidróxido de potássio.
- Bateria de Níquel-Hidreto Metálico (NiMH): Similar à NiCd, mas usa uma liga metálica no ânodo em vez de cádmio.
- Bateria de Íons de Lítio (Li-ion): Usada em celulares e laptops. Alta densidade energética, sem efeito memória. Ânodo de grafite, cátodo de óxido de lítio-cobalto e eletrólito de sal de lítio.
Pilhas de Combustível
Convertem energia química de um combustível (como hidrogênio) diretamente em eletricidade, sem combustão. Serão abordadas em mais detalhes no Capítulo 4.
Aplicações das Pilhas Eletroquímicas
As pilhas eletroquímicas têm inúmeras aplicações em nosso cotidiano e na indústria:
- Dispositivos eletrônicos portáteis: Celulares, laptops, tablets, câmeras, relógios, etc.
- Veículos: Baterias de partida em automóveis, baterias de tração em veículos elétricos e híbridos.
- Armazenamento de energia: Sistemas de backup, armazenamento de energia renovável (solar, eólica).
- Dispositivos médicos: Marca-passos, aparelhos auditivos, bombas de insulina.
- Aplicações industriais: Sistemas de energia ininterrupta (UPS), equipamentos de emergência.
- Aplicações espaciais: Satélites, sondas espaciais, rovers.
Impacto Ambiental e Descarte
Apesar de sua utilidade, as pilhas e baterias podem causar sérios impactos ambientais se não forem descartadas corretamente:
- Contêm metais pesados tóxicos como chumbo, cádmio e mercúrio, que podem contaminar solo e água.
- Algumas baterias contêm ácidos e bases fortes que são corrosivos.
- O lítio é altamente reativo com água e pode causar incêndios.
No Brasil, a Política Nacional de Resíduos Sólidos (Lei 12.305/2010) e a Resolução CONAMA 401/2008 regulamentam o descarte de pilhas e baterias. Os fabricantes e importadores são obrigados a implementar sistemas de logística reversa para coletar e dar destinação adequada a esses produtos após o uso.
Como consumidores, devemos:
- Nunca descartar pilhas e baterias no lixo comum.
- Entregar em pontos de coleta específicos (lojas, supermercados, assistências técnicas).
- Preferir pilhas recarregáveis quando possível, reduzindo o volume de descarte.
- Armazenar pilhas usadas em recipientes secos e isolados até o descarte adequado.
Exercícios Interativos
Vamos testar seus conhecimentos sobre pilhas eletroquímicas:
1. Em uma pilha eletroquímica, onde ocorre a oxidação?
2. Qual é a função da ponte salina em uma pilha?
3. Considerando os potenciais padrão de redução: E°(Ag⁺/Ag) = +0,80V e E°(Ni²⁺/Ni) = -0,25V, qual é a força eletromotriz (ddp) da pilha formada por esses elementos?
Mapa Mental do Capítulo
Aqui você encontrará a tradução em Libras do conteúdo principal deste capítulo. Nosso objetivo é tornar o aprendizado de Eletroquímica acessível a todos!