Capítulo 1: Mergulhando na Eletroquímica - Redox e Nox
Olá! Sou o Leo. Vamos juntos explorar o fascinante mundo da Eletroquímica? Neste capítulo, vamos entender a base de tudo: as reações de oxirredução, ou Redox, e como determinar o Número de Oxidação (Nox). Preparados?
O que é Eletroquímica?
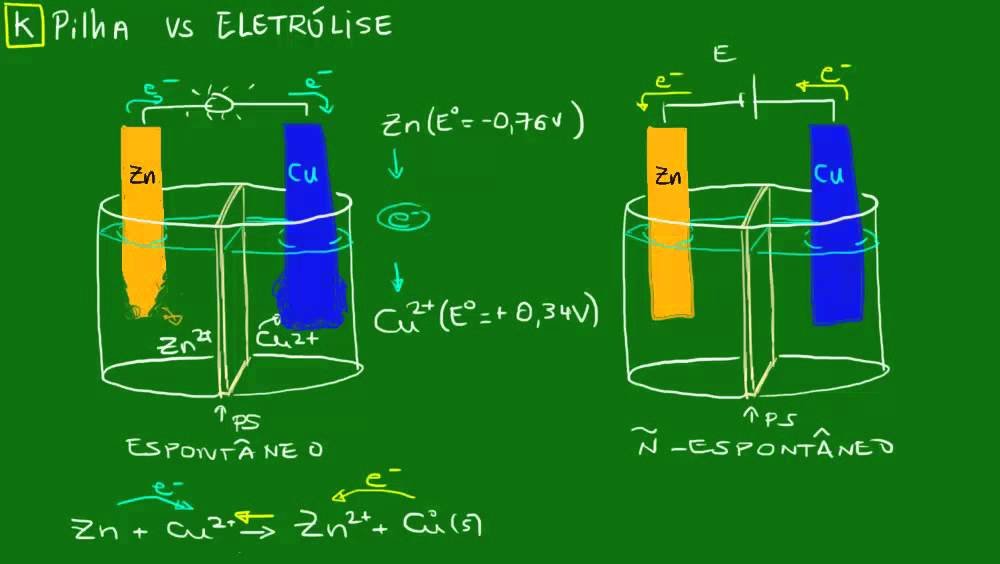
Imagine poder transformar a energia de uma reação química diretamente em eletricidade, como acontece nas pilhas e baterias que usamos todos os dias. Ou, o contrário, usar eletricidade para fazer acontecer uma reação química que não ocorreria sozinha, como na produção de metais ou no revestimento de objetos. Isso é a Eletroquímica! Ela estuda justamente essa relação entre reações químicas e energia elétrica.
Como mencionado em diversos estudos brasileiros sobre o ensino de Eletroquímica com abordagem CTS (Ciência, Tecnologia e Sociedade), entender esses processos nos ajuda a refletir sobre o funcionamento e o impacto das tecnologias que usamos, como as pilhas, e a importância do descarte correto.
Reações de Oxirredução (Redox): A Base de Tudo
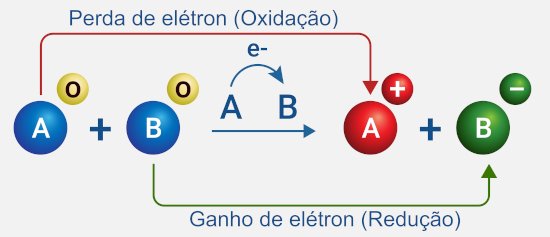
O coração da Eletroquímica são as reações de oxirreduçãoTambém chamadas de reações Redox. São reações onde ocorre transferência de elétrons entre as espécies químicas.. Nessas reações, algumas espécies químicas perdem elétrons (sofrem oxidaçãoProcesso de perda de elétrons. A espécie que oxida é chamada de agente redutor.) enquanto outras ganham elétrons (sofrem reduçãoProcesso de ganho de elétrons. A espécie que reduz é chamada de agente oxidante.). É essa "dança" de elétrons que pode gerar ou consumir corrente elétrica.
Pense na ferrugem do ferro: o ferro metálico reage com o oxigênio do ar (na presença de umidade) e se transforma em óxido de ferro (ferrugem). Nessa transformação, o ferro perde elétrons (oxida) e o oxigênio ganha elétrons (reduz). É uma reação Redox espontânea!
Número de Oxidação (Nox): O "RG" do Elétron
Oi, pessoal! Sou a Sofia. Para acompanhar essa transferência de elétrons nas reações Redox, usamos o Número de Oxidação, ou Nox. Pensem no Nox como uma carga teórica que um átomo teria se todos os elétrons das suas ligações fossem para o átomo mais eletronegativo. Mesmo com a visão reduzida, consigo "ver" as estruturas moleculares com modelos táteis, e entender o Nox ajuda a prever como as reações vão acontecer!
O Nox é fundamental porque sua variação indica quem oxidou e quem reduziu:
- Se o Nox de um átomo aumenta durante a reação, ele perdeu elétrons (sofreu oxidação).
- Se o Nox de um átomo diminui durante a reação, ele ganhou elétrons (sofreu redução).
- Se o Nox não muda, o átomo não participou da transferência de elétrons (pode ser um íon espectador).
Calculando o Nox: Regras Práticas
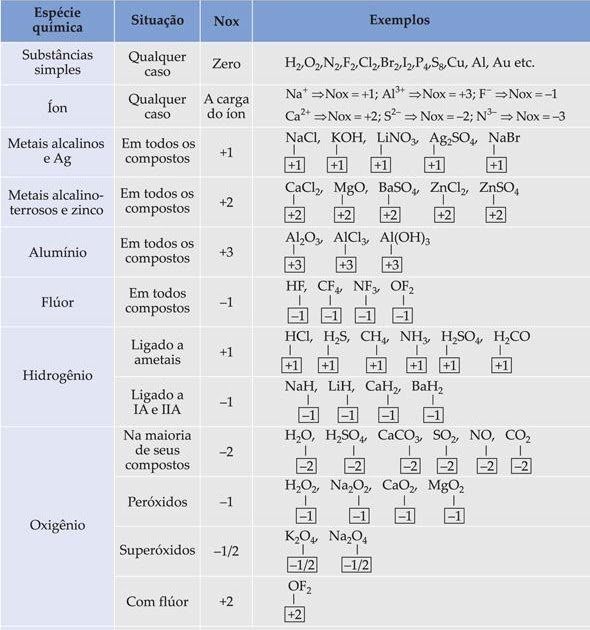
Calcular o Nox pode parecer complicado, mas existem algumas regras que facilitam muito! Vamos ver as principais:
- Substâncias Simples: O Nox de um átomo em uma substância simples (formada por um único elemento, como O2, Fe, S8) é sempre zero.
- Íons Monoatômicos: O Nox de um íon formado por um único átomo (como Na+, Cl-, Fe3+) é igual à sua própria carga.
- Hidrogênio (H): Geralmente, o Nox do hidrogênio é +1. Exceção: em hidretos metálicos (como NaH, CaH2), seu Nox é -1.
- Oxigênio (O): Geralmente, o Nox do oxigênio é -2. Exceções: em peróxidos (como H2O2), é -1; em superóxidos (como KO2), é -1/2; e quando ligado ao Flúor (OF2), é +2.
- Metais Alcalinos (Grupo 1): O Nox é sempre +1 em compostos.
- Metais Alcalinoterrosos (Grupo 2): O Nox é sempre +2 em compostos.
- Halogênios (Grupo 17): Geralmente, o Nox é -1 em compostos binários com elementos menos eletronegativos. Pode variar em outros compostos (ex: HClO4, onde Cl é +7).
- Soma dos Nox:
- Em uma molécula neutra, a soma dos Nox de todos os átomos é zero.
- Em um íon composto, a soma dos Nox de todos os átomos é igual à carga do íon.
Exemplo Prático: Calculando o Nox no H2SO4 (Ácido Sulfúrico)
Vamos usar as regras para encontrar o Nox do Enxofre (S) no H2SO4:
- Sabemos que o H geralmente tem Nox +1 (Regra 3). Como temos 2 H, a contribuição total é 2 * (+1) = +2.
- Sabemos que o O geralmente tem Nox -2 (Regra 4). Como temos 4 O, a contribuição total é 4 * (-2) = -8.
- A molécula H2SO4 é neutra, então a soma total dos Nox deve ser zero (Regra 8a).
- Chamando o Nox do S de 'x', temos: (Nox do H) + (Nox do S) + (Nox do O) = 0
- Substituindo: 2 * (+1) + x + 4 * (-2) = 0
- Simplificando: +2 + x - 8 = 0
- Resolvendo: x = +6
Portanto, o Nox do Enxofre no H2SO4 é +6.
Mais Exemplos: Prática Faz a Perfeição
Oi! Sou o Davi. Vamos praticar mais alguns exemplos de cálculo de Nox? Mesmo com minha deficiência auditiva, consigo acompanhar perfeitamente os cálculos através das explicações visuais e dos exemplos escritos. Vamos lá!
Vamos calcular o Nox de alguns elementos em diferentes compostos:
- Nox do Manganês (Mn) no KMnO4 (Permanganato de Potássio):
- K: +1 (metal alcalino)
- O: -2 (regra do oxigênio) × 4 = -8
- Mn: x (a determinar)
- Como a molécula é neutra: +1 + x + (-8) = 0
- Resolvendo: x = +7
- Nox do Cloro (Cl) no íon ClO3- (Íon Clorato):
- O: -2 (regra do oxigênio) × 3 = -6
- Cl: x (a determinar)
- Como o íon tem carga -1: x + (-6) = -1
- Resolvendo: x = +5
- Nox do Nitrogênio (N) no NH4+ (Íon Amônio):
- H: +1 (regra do hidrogênio) × 4 = +4
- N: x (a determinar)
- Como o íon tem carga +1: x + (+4) = +1
- Resolvendo: x = -3
Exercícios Interativos
1. Qual é o Nox do Cr no K2Cr2O7?
2. Qual é o Nox do P no H3PO4?
3. Qual é o Nox do Fe no Fe2O3?
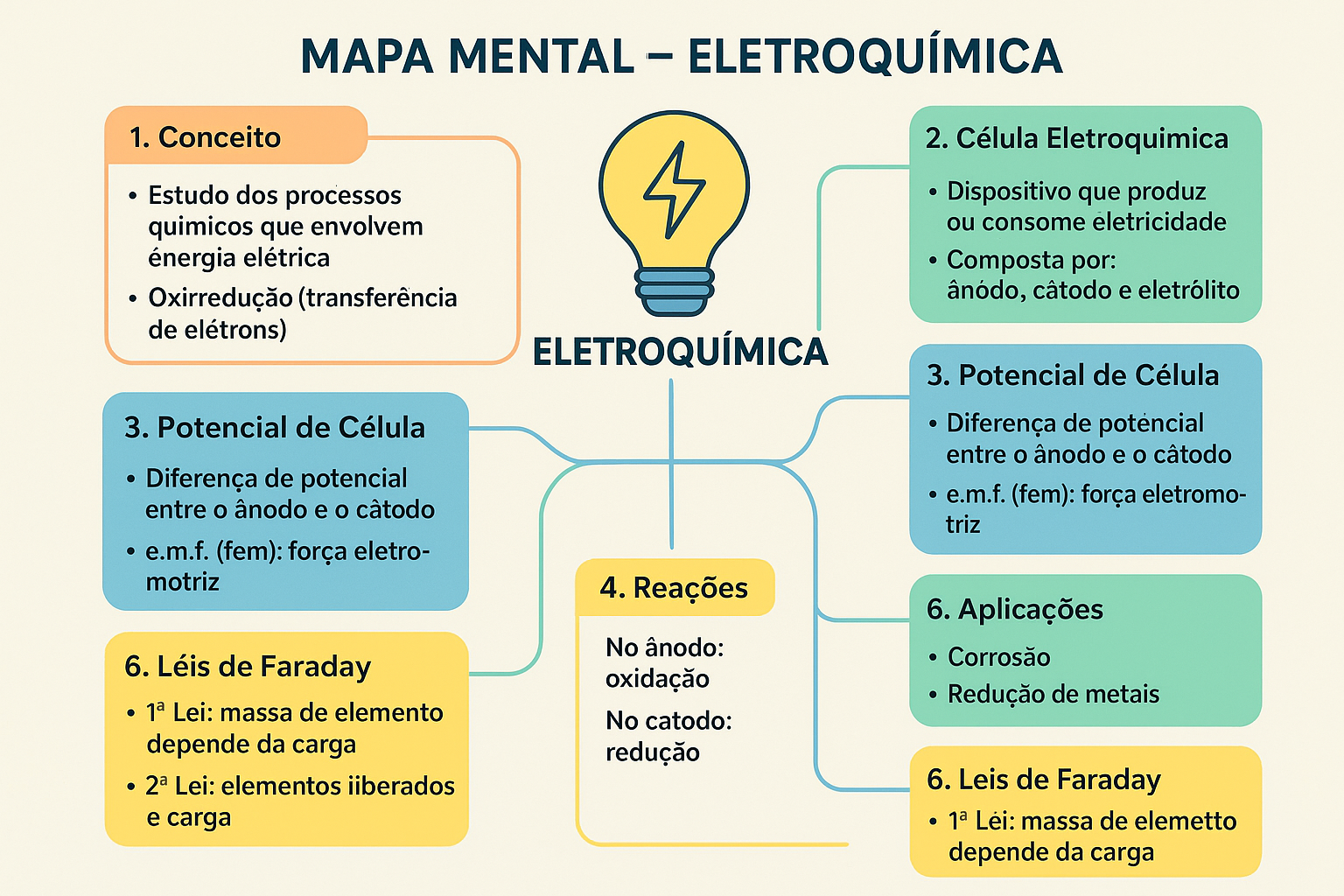
Mapa Mental do Capítulo
Libras: Conteúdo em Língua Brasileira de Sinais
Aqui você encontrará a tradução em Libras do conteúdo principal deste capítulo. Nosso objetivo é tornar o aprendizado de Eletroquímica acessível a todos!
Material Complementar para Download
Aprofunde seus estudos com os slides e atividades abaixo:
-
Slides: Eletroquímica no Dia a Dia Pilhas, corrosão e fenômenos cotidianos.
-
Slides: A Química que Gera Energia Conceitos de Redox, NOX e Pilhas de Lítio.
-
Slides: Eletroquímica - Conceitos e Aplicações Pilhas de Daniell, Eletrólise e Série Eletroquímica.
-
Questionário de Conhecimentos Prévios Atividade inicial para testar o que você já sabe.